Desde la finalización del proyecto genoma humano, hemos vivido una revolución científica en el campo de la genética aplicada, que está cambiando a una velocidad sin precedentes el conocimiento científico de aquellas disciplinas que se encuentran íntimamente relacionadas.
La neurología pediátrica es una de las más afectadas por esta revolución genómica, debido a la sobrerepresentación del sistema nervioso central (y su desarrollo) en el código genético, como consecuencia de su complejidad y prolongado tiempo de desarrollo (el mayor de todos los órganos del ser humano).
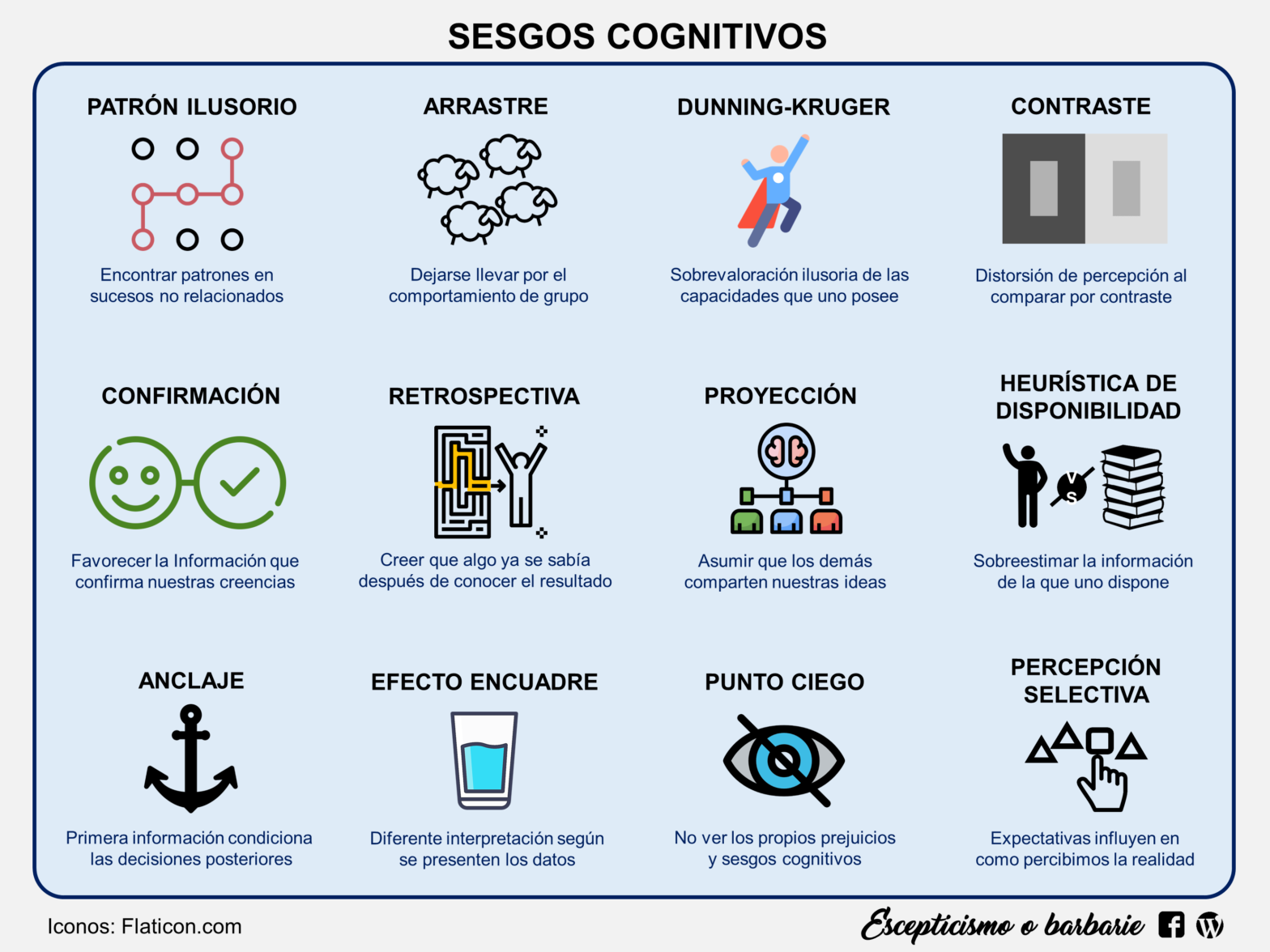
No obstante el genoma humano sigue sorprendiéndonos por su complejidad, y aún no tenemos explicación para todos los fenómenos biológicos que explican las enfermedades neurogenéticas. Esta falta de conocimiento científico debe hacernos tener cuidado a la hora de extraer conclusiones, ya que podemos incurrir en sesgos cognitivos, como por ejemplo:
- Sesgo de confirmación: Las personas tienden a favorecer información que confirma sus creencias preexistentes y a ignorar o descartar información que las contradice. Por ejemplo, si disponemos de antecedentes familiares sugerentes de una enfermedad genética, puede que desestimemos información relevante sobre una variante de novo, y interpretemos como más significativa una variante genética heredada.
- Sesgo de disponibilidad: Tendemos a dar más peso a la información que resulta fácilmente disponible, lo que puede llevar a sobrestimar la importancia de ciertos genes o mutaciones debido a la atención mediática o a la disponibilidad de información sobre ellos.
- Sesgo de representatividad: Este sesgo se refiere a la tendencia a juzgar la probabilidad de un evento basándose en cuán representativo parece de una categoría o prototipo en particular, lo que da lugar a suposiciones erróneas sobre la probabilidad de ciertas enfermedades o rasgos basadas en la apariencia de una persona o en estereotipos.
- Sesgo de anclaje: Las personas tienden a depender demasiado de la primera información que reciben al tomar decisiones. En genética humana, esto podría manifestarse al sobrevalorar la importancia de ciertas pruebas genéticas o interpretar los resultados de manera desproporcionada en función de información previa.
- Sesgo de optimismo: Las personas tendemos a creer que somos menos propensas a experimentar eventos negativos y más propensas a experimentar eventos positivos, esto puede influir en la percepción del riesgo de enfermedades genéticas o en la interpretación de las implicaciones de los resultados de pruebas genéticas, como por ejemplo, que un resultado negativo en un test genético no significa que no exista una enfermedad genética.
- Sesgo de autoridad: Las personas tendemos a confiar en la información proporcionada por figuras de autoridad o expertos, incluso si esta información es incorrecta. En genética humana, esto podría llevar a aceptar información errónea o incompleta proveniente de fuentes consideradas confiables.
- Sesgo de retrospectiva: También conocido como «efecto de conocimiento posterior», es la tendencia a ver eventos pasados como si hubieran sido predecibles en el momento en que ocurrieron. Esto puede llevar a interpretaciones erróneas de la causalidad genética en situaciones en las que la información genética solo se descubrió después de un evento.
Por otro lado, cuando aplicamos los conocimientos científicos sobre neurogenética en la práctica clínica, tendemos a utilizar un marco cognitivo o paradigma que puede llevarnos a conclusiones equivocadas. Entre las distintas falacias que solemos utilizar, se encuentran:
- Asunción 1 gen – 1 enfermedad. La idea de «1 gen, 1 enfermedad» es una simplificación excesiva de la genética humana. Si bien existen algunas enfermedades genéticas causadas por mutaciones en un solo gen específico, la mayoría de las enfermedades son el resultado de interacciones complejas entre múltiples factores genéticos y ambientales. Existe heterogeneidad genética y heterogeneidad fenotípica, algunos genes tienen un comportamiento cuantitativo, y puede existir modulación y interrelación entre ellos, dando lugar a consecuencias dificilmente predecibles.
- Asunción 1 genoma – 1 indivíduo. La afirmación «1 genoma, 1 individuo» también es una simplificación excesiva de la genética humana y la diversidad genética presente en un único indivíduo. Sin embargo la realidad es más compleja, existen múltiples situaciones en las que se produce mosaicismo genético (tanto somático como constitucional, como germinal), e incluso existen las quimeras genéticas, por lo que es necesario tener en cuenta toda esta variabilidad a la hora de llegar a conclusiones correctas.
- Asunción del genoma como código inmutable y perdurable. Aunque el genoma humano es altamente estable y se transmite de generación en generación con una gran precisión, no es completamente inmutable y puede experimentar cambios a lo largo del tiempo debido a diversas razones. En particular, existen mecanismos genéticos especialmente dinámicos, como por ejemplo:
- Los jumping genes, también conocidos como elementos transponibles o transposones, son secuencias de ADN que tienen la capacidad de moverse de una posición a otra dentro del genoma. Estos elementos son responsables de lo que se llama «transposición», un proceso en el cual una porción de ADN se corta y se inserta en otro lugar del genoma, ya sea en el mismo cromosoma o en otro cromosoma.
- Las mutaciones dinámicas, también son otro elemento que puede variar a lo largo del tiempo con las distintas mitosis. Las mutaciones dinámicas son un tipo especial de mutación genética que implica cambios en la longitud de secuencias de ADN repetitivas en el genoma. La longitud de la repetición puede aumentar o disminuir a lo largo de las generaciones debido a la inestabilidad en la replicación del ADN. La cantidad de repeticiones en una región particular del genoma puede afectar la función del gen y estar asociada con diversas enfermedades.
- Asunción del exoma = único contenedor de información genética. Además de las secuencias codificantes, existen otros mecanismos que modulan y regulan la expresión de los genes, y que pueden dar lugar a enfermedad, como el epigenoma. A menudo obviamos su importancia, pese a que aproximadamente el 98% del genoma humano no codifica directamente proteínas. Sin embargo, gran parte de este ADN no codificante tiene funciones reguladoras, estructurales y epigenéticas, aunque no disponemos aún de suficiente conocimiento científico sobre su funcionamiento, éste es mucho más complejo y la mayor parte de las herramientas clínicas no permiten su estudio en la práctica habitual.
- Asunción de los patrones mendelianos de herencia como única forma de herencia. A menudo olvidamos que existen otros patrones de herencia además de los clásicos autosómico dominante, autosómico recesivo y ligado al X. Los patrones de herencia no mendelianos se refieren a las formas de transmisión de rasgos genéticos que no siguen las reglas clásicas de Mendel, las leyes de segregación y distribución independiente de los alelos, sino que involucran fenómenos genéticos más complejos que no se ajustan a estas. Algunos ejemplos de patrones de herencia no mendelianos incluyen:
- Codominancia: En lugar de tener un alelo dominante y un alelo recesivo, en la codominancia ambos alelos se expresan por igual en el fenotipo del individuo heterocigoto. Un ejemplo es el grupo sanguíneo AB, donde ambos alelos A y B se expresan en la superficie de los glóbulos rojos.
- Dominancia incompleta: En este patrón, el fenotipo heterocigoto muestra una mezcla de los fenotipos de los alelos homocigotos. Por ejemplo, en el caso de la flor de color rosa en ciertas especies de plantas, un alelo rojo y un alelo blanco dan lugar a un fenotipo intermedio de color rosa.
- Herencia mitocondrial: Las mitocondrias, estructuras celulares relacionadas con la producción de energía, tienen su propio ADN. Las enfermedades mitocondriales se heredan de la madre debido a que las mitocondrias se transmiten principalmente a través del óvulo.
- Herencia epigenética: No todas las características heredadas son causadas por cambios en la secuencia de ADN. La herencia epigenética implica cambios en la expresión génica debido a modificaciones químicas en el ADN o en las histonas. Estos cambios pueden transmitirse de una generación a otra y afectar la herencia de rasgos.