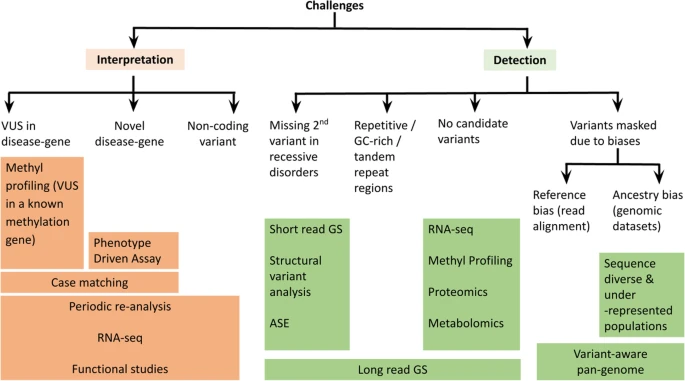
Nos encontramos evaluando a un niño con un trastorno del neurodesarrollo, en el que sospechamos la existencia de una causa genética porque presenta datos sugerentes al respecto (malformaciones congénitas múltiples asociadas, por ejemplo). Hemos realizado un aCGH que ha resultado ser normal. También hemos realizado un exoma clínico (mendelioma) que no nos ha aportado información concluyente. ¿Por donde continuamos?
Reevalúa las variantes de significado incierto.
Revisa los apéndices del estudio genético en busca de información relevante.
Puede que el genetista haya identificado una variante patogénica en un gen recesivo, que sea compatible con tu sospecha clínica, pero al no encontrar una segunda variante patogénica, no lo ha reportado en el cuerpo de texto principal. Si el fenotipo es congruente con la sospecha clínica, quizá tengas que proseguir investigando:
Asegúrate de que no exista una variante de significado incierto en el otro alelo.
Para confirmarlo es necesario realizar un estudio de cosegregación de ambos padres, en caso de que ambas variantes se encuentren en trans, tu diagnóstico de sospecha se verá reforzado.
Revisa la existencia de biomarcadores.
En caso de que el gen autosómico recesivo disponga de biomarcadores que permitan su estudio, puede ser una estrategia eficiente realizar un estudio dirigido (enzimático, bioquímico) y en caso de detectar anormalidades, realizar pruebas diagnósticas más sofisticadas (secuenciación del RNA) en busca de mutaciones intrónicas profundas.
Valora la posibilidad de realizar un MLPA del gen afectado.
Pueden combinarse varios mecanismos mutacionales (heterocigosis compuesta), ten en cuenta que las delecciones de pequeño tamaño pueden haber pasado desapercibidas en ambas pruebas (exoma y aCGH).
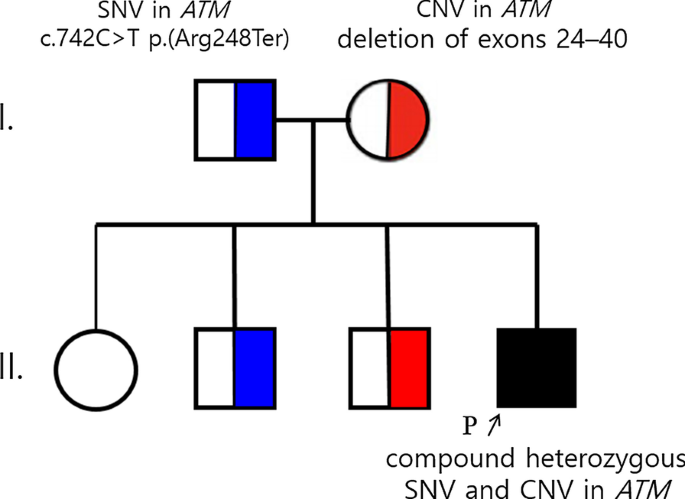
Revisa la posibilidad de que se trate de una enfermedad no diagnosticable por secuenciación.
Existen algunas enfermedades genéticas no diagnosticables por secuenciación del exoma con la tecnología disponible actualmente. Si el fenotipo es compatible con alguna de ellas, puede ser necesario solicitar pruebas diagnósticas específicas.
Reevalúa el fenotipo cada cierto tiempo en busca de nuevos síntomas orientadores.
Puedes tratar de refinar tu descripción fenotípica utilizando los códigos del HPO. De esta forma facilitaras la aplicación de filtros informáticos por parte del genetista para el reanálisis de los datos.
Con la descripción fenotípica a través de los códigos HPO puedes utilizar herramientas de diagnóstico diferencial informatizadas, como phenomyzer.
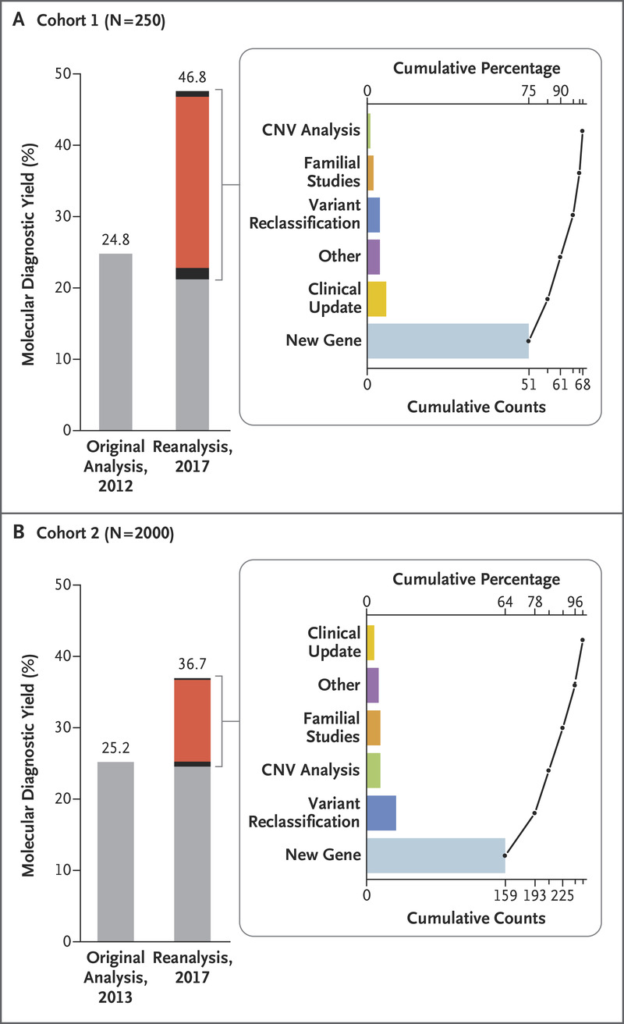
Solicita a tu genetista que reanalice los datos brutos de secuenciación tras 2-5 años si no lo ha hecho automáticamente.
Existen múltiples publicaciones científicas que demuestran un incremento de entre el 10-15% de la rentabilidad diagnostica mediante el reanálisis de los datos de secuenciación a los 12-24 meses de su realización. Esto es consecuencia de la rápida acumulación de conocimiento científico que está produciéndose:
- El descubrimiento de nuevos genes patogénicos.
- La clarificación de la patogenicidad de variantes previamente no involucradas en enfermedad.
- El refinamiento de las variantes poblacionales en el genoma de referencia (Genome Reference Consortium).
- Los estudios de cosegregación realizados en otras familias.
- La mejora técnica en la aplicación de filtros en el procesamiento de datos bioinformáticos (estudio de CNV a partir de los datos de secuenciación, por ejemplo).
Valora la posibilidad de realizar una secuenciación del exoma en trío (investigación).
La secuenciación del exoma en trío (caso índice, padre, madre) permite cruzar los datos de los familiares para aplicar filtros que eliminen las variantes genéticas poco frecuentes que hayan sido heredadas, en busca de variantes de novo en genes aún no estudiados por completo que puedan ser candidatas a explicar el fenotipo. Es una técnica que da su mayor potencial cuando se aplica de forma sistemática en el contexto de un proyecto de investigación, puesto que permite descubrir nuevos genes involucrados en enfermedad y demostrar su patogenicidad a través de técnicas experimentales.
Inicia una investigación en red con otros profesionales.
La Undiagnosed Diseases Network es una red de investigación de enfermedades sin diagnóstico, en la que participan profesionales de varios países y que actúa como facilitadora en la investigación de enfermedades raras. Existe una sede española que depende del ISCIII, y se llama SPAINUDP.